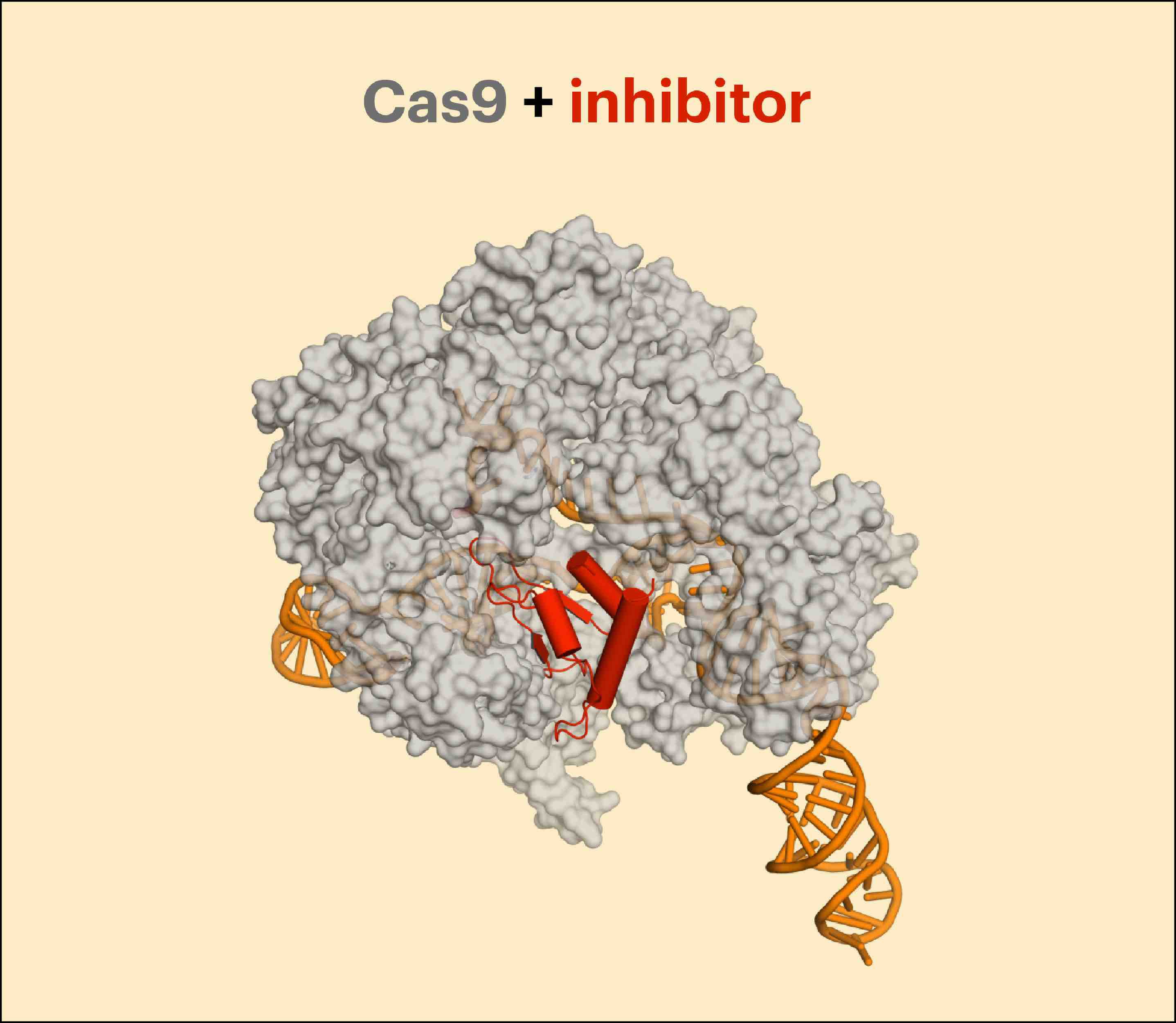
这篇文章是关于建立安全的 CRISPR 基因编辑 治愈人类疾病。 请注意,我做了 不能 说这个帖子是关于 基因 编辑 脱靶. 我们会到达那里,但你可能会对我要说的话感到惊讶。
与某些人可能的情况相反 说或写,在谈到安全问题时,我们大多数基因编辑者都没有把头埋在沙子里。 从临床前、发现研究的角度来看,给定基因编辑技术的安全性相对没有意义。 那里有许多肮脏的小分子,你永远不想把它们放在一个人身上,但它们对于帮助解开新生物学非常有用。 鉴于临床前研究人员可以奢侈地做诸如补充/重新表达 实验和隔离多个独立的克隆,让我们将每个人对 CRISPR 的个人研究经验(此时都是临床前)与安全问题分开。 这些经验有用且信息丰富,但到目前为止都是轶事,不一定与诊所密切相关。
尽管我们基因编辑喜欢这么想,但 CRISPR 安全并不是一个充满未知领域的全新世界。 虽然有一些重要的未解决的问题,但有很多先例。 不仅其他基因编辑技术已经应用于临床,而且是非特异性的 的DNA 破坏性药物实际上是有效的化学疗法(例如 顺铂, 替莫唑胺, 依托泊苷)。 在后一种情况下,DNA 损伤的混乱是治疗的重点。
以下是关于理论上的 CRISPR 基因编辑疗法的安全性的一些想法,主要以随机顺序排列。 首先我要说的是,虽然我在制药行业有经验,但我绝不是临床安全方面的专家,而且要听从真正的巫师。
安全是关于风险与回报
让我们从一个重要的观点开始:与任何疾病一样,基因编辑疗法的安全性完全取决于适应症。 治疗的安全性概况 胶质母细胞瘤 (对于快速进展的致命疾病,很少有好的治疗选择)将与湿疹的治疗大不相同。 将无进展生存期仅增加两天的胶质母细胞瘤治疗的安全耐受性看起来与将总体生存期增加五年的治疗不同。 因此,基因编辑的安全性不会有一个真正的规则,因为大部分方程式将由疾病而不是治疗来编写。
基因编辑安全与功能性基因毒性有关
虽然大多数安全方程式都与疾病有关,但治疗本身当然需要考虑在内。 从本质上讲,基因编辑试剂是 DNA 损伤剂,因此基因毒性是一个大问题。 干预本身是否会破坏肿瘤抑制因子并导致 癌症? 它会破坏关键的代谢吗 酶 并导致 细胞 死亡? 如上所述,有大量的 DNA 损伤剂会对人体造成严重破坏。 基因组,但由于风险/回报和缺乏更好的选择而被容忍(我特意看着你,替莫唑胺). 这一点的关键是 功能 什么被打乱了。
使用 CRISPR,我们具有显着的优势,即 指导RNA 倾向于击中基因组中的某些位置。 我们知道如何设计目标,并且仍在弄清楚如何预测和衡量脱靶。 但即使有完美的脱靶方法,我们仍然需要进行功能测试。 考虑一种“传统”疗法(小分子或生物制剂)——而 细胞/组织 基于生物化学的脱靶面板很有价值,它根本无法替代正常与肿瘤杀伤曲线(例如)。 甚至那些杀伤曲线也不能替代动物模型。 基因编辑试剂的长期功能安全性是关键问题,对于 CRISPR,我认为我们还为时过早,不知道会发生什么。 好消息是 ZFN 到目前为止看起来还不错,让我对基因编辑作为一个班级充满了希望。
基因编辑安全与序列列表无关
您可能认为确定一份详尽的脱靶序列列表将是任何 CRISPR 安全性的关键部分。 但在上面的例子中,对比 细胞/组织 使用生物模型进行生化分析时,我认为脱靶列表等同于生化分析。 我将故意引起争议,并假设,对于治疗候选者,您不应该在其脱靶位点列表上过分重视。 如上所述,您应该关心那些偏离目标的人在做什么,为此您甚至可能不需要知道偏离目标的位置。
在临床前模式中选择候选疗法时,脱靶序列列表对于确定试剂的优先顺序非常有用。 如果一位导游 RNA 命中两个脱靶位点,再命中 XNUMX 个,您可能会选择前者而不是后者。 但是,如果两个脱靶之一是 p53? 如果这 XNUMX 个都是基因间的呢? 鉴于对致癌基因的适应性优势 突变,使用测序(甚至基于捕获的技术)检测非常罕见的脱靶位点所涉及的数学是令人生畏的。 能够检测到百万分之一的基于序列的事件听起来不可思议,但是如果您需要编辑多达 1 万个细胞用于骨髓移植怎么办? 那是二十个细胞,你可能会癌变,但你甚至都不知道。 现在我们又回到了功能上——你应该更关心基因编辑的功能效果,而不是序列列表。 该序列列表对于数量级来说很好,并且对于选择候选试剂很有用,但它不能替代功能。
基因编辑的安全性与免疫原性有关吗?
关于基因编辑免疫原性有两个大问题:试剂本身的免疫原性,以及如果编辑引入了对患者来说是新的序列的靶向免疫原性。 当试剂本身诱导长期免疫反应时会发生什么? 对于需要重复给药的疗法,这可能会终止程序(因此需要投入大量工作) 人源化抗体)。 导致某人在服用第二剂后病重的疗法效果不佳,如果针对该疗法产生的抗体最终阻止了治疗,则也无济于事。 但是关于 原位 基因编辑?
最 原位 基因编辑试剂是合成的或 细菌 因此,人们可能会产生针对它们的抗体,但治疗本身(理想情况下)是一次性治疗。 那样的话,只要没有强烈的幼稚免疫反应,也许你开发出针对编辑试剂的抗体就没有关系了? 对于 CRISPR,这里的答案很少,而且大多数与 ZFN 相关的工作都是与 体外 编辑,其中免疫系统不暴露于编辑试剂。 时间会证明这是否是一个问题,而动物模型将是关键。 更微妙的是,当基因编辑导致“正常”的重新表达时会发生什么? 蛋白质 患者以前从未表达过(例如编辑镰状密码子以将突变血红蛋白转化为野生型血红蛋白)?
针对新的“自身”蛋白质的新免疫反应的潜力可能与变化的程度有关——一个单一的 氨基酸 变化(例如镰状细胞)可能比引入一个更不可能引起问题 转基因 (例如 Sangamo 将酶插入白蛋白基因座的工作 溶酶体贮积症 和 血友病)。 但是再一次,我听到了很多问题,担心这个问题,但答案很少。 体内 迫切需要实验,而且越接近人类免疫系统越好。
根据预测数据向前推进
正如您现在可能已经收集到的那样,当涉及到安全性时,我非常尊重功能特性。 这就是为什么我们必须继续前进,不要让对任意数量的脱靶的理论上的担忧在没有数据的情况下扼杀创新,这是绝对重要的。 这些工具有朝一日可以帮助迫切需要且几乎没有其他选择的患者,所以让真正的预测 实用 数据统治了这一天。