COVID-19 依靠 Cell 的“主调节器”生存
加州大学旧金山分校新闻 | 杰森阿尔瓦雷斯 | 29 年 2020 月 XNUMX 日
由 IGI 调查员 Nevan Krogan 领导的加州大学旧金山分校科学家组建了一个国际研究小组,该小组已经弄清楚如何 SARS-COV-2是, 病毒 这会导致 COVID-19,劫持 蛋白质 在主机 细胞 充当关键细胞过程的主调节器。 通过这样做,病毒能够重新连接细胞的内部电路以促进其自身的传播和存活。 但病毒对宿主细胞蛋白质的依赖也可能被证明是它的致命弱点,因为这些相同的蛋白质可以很容易地被现有药物靶向。
在 28 年 2020 月 XNUMX 日发表的一项研究中, 手机,研究人员发现,当 SARS-CoV-2 感染细胞时,它会控制一个家族 酶 称为激酶。 在正常情况下,激酶作为代谢、生长、运动、修复和其他重要细胞功能的主要调节剂。 激酶通过称为磷酸化的过程将微小的化学标签附加到蛋白质上。 一旦附着,这些标签就会作为开关打开或关闭蛋白质,从而使细胞的复杂机制保持平稳运行。

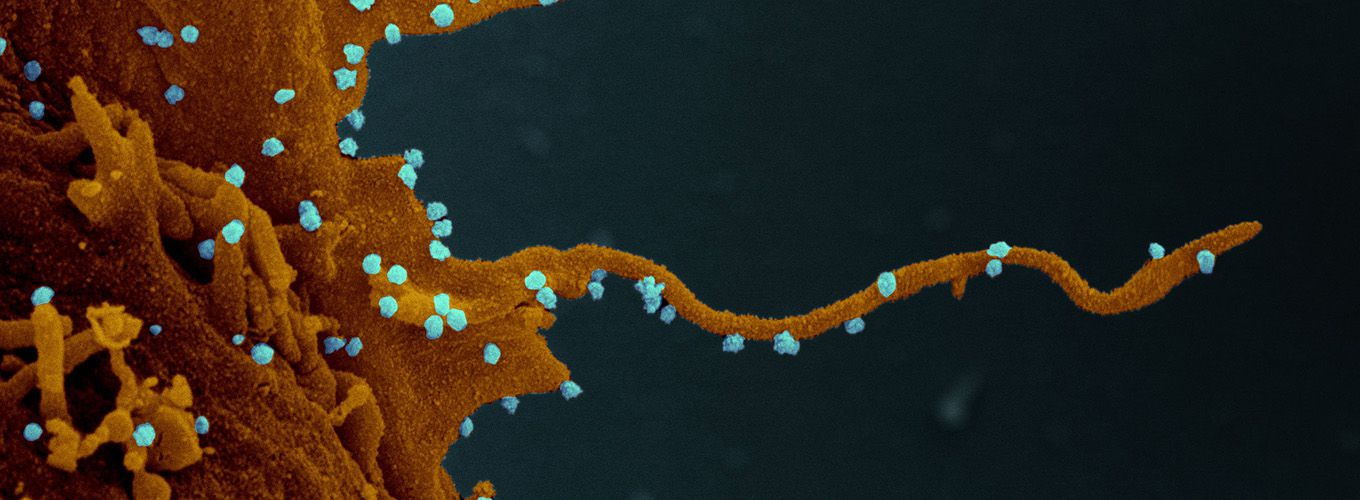
然而,当一个细胞被 SARS-CoV-2 征用时,这些相同的激酶的行为方式会破坏正常细胞功能并将宿主细胞转化为病毒工厂。 细胞分裂停止,炎症通路被激活,细胞甚至开始产生称为丝状伪足的触手状结构,这些结构从细胞表面突出,可作为分子高速公路,帮助病毒迅速传播到邻近细胞。
这些新发现建立在 2 月份发表的一篇被广泛引用的论文之上,该论文是最早描绘出 SARS-CoV-19 与感染细胞时遇到的蛋白质相互作用的多种方式的论文之一。 该研究还确定了一些能够阻断这些相互作用的现有药物,使其成为具有吸引力的候选药物,可用作 COVID-XNUMX 的治疗方法。
这两项工作均由加州大学旧金山分校的定量生物科学研究所 (QBI) 牵头。 在 COVID-19 成为对全球健康的威胁后不久,QBI 主任 Nevan Krogan 博士召集了一支由数十名加州大学旧金山分校科学家组成的团队,他们代表着广泛的科学学科,努力从尽可能多的角度应对这一流行病。 QBI 冠状病毒研究小组 (QCRG),作为现在已知的跨学科团队,包括许多在激酶以及可用于禁用它们的药物方面具有专业知识的科学家。
几十年来,激酶及其控制的信号通路一直是严格科学审查的主题,这在很大程度上是因为异常激酶活性经常与 癌症. 多年来,这促使科学家们开发了数十种针对这些酶的药物——这些药物最初旨在用于癌症治疗,但可能用于抑制激酶依赖性 病毒 比如SARS-CoV-2。
SARS-CoV-2 对激酶的这种依赖性在实验中得到了揭示,在该实验中,研究人员对在受感染和未受感染细胞中发现的所有蛋白质进行了计数和编目。 尽管他们观察到每组蛋白质总量没有显着差异,但科学家们注意到磷酸化水平存在巨大差异——这是 SARS-CoV-2 正在改变受感染细胞中激酶行为的明显迹象。
“通过对 SARS-CoV-2 感染细胞时磷酸化的变化进行系统分析,我们确定了几个关键因素,这些因素不仅将为生物学研究的下一个领域提供信息,而且将为可能被重新用于治疗 COVID- 19 日,”加州大学旧金山分校细胞和分子药理学教授、格莱斯顿研究所高级研究员、新研究的共同资深作者克罗根说。
第一作者、Krogan 实验室的博士后研究员 Mehdi Bouhaddou 博士与格莱斯顿研究所的 Danielle Swaney 和位于英国剑桥的欧洲分子生物学实验室欧洲生物科学研究所的 Pedro Beltrao 合作进行的进一步分析显示,有 49 种激酶表现出受感染细胞的异常活动。 特别是,研究人员发现,经过充分研究的称为 p38/MAPK 通路的激酶网络明显更加活跃,该通路已知会引发炎症诱导细胞因子的产生。 这一发现可能有助于解释所谓的细胞因子风暴——一种损害器官的过度活跃的免疫反应——通常与严重的 COVID-19 病例相关。 研究人员还发现,控制细胞周期的 CDK 激酶在感染期间的活性显着降低,从而停止了细胞分裂的资源密集型过程,以便将更多资源用于病毒生产。
但也许最令人惊讶的是国际团队发现 SARS-CoV-2 激活了一种称为 CK2 的激酶,这反过来似乎刺激了丝状伪足的产生,丝状伪足是从细胞表面伸出的微小触手状突起。
使用显微镜技术,由医学博士 Robert Grosse 领导的德国弗莱堡大学的一个小组表明,SARS-CoV-2 和 CK2 在受感染的细胞中“共定位”,这可能有助于形成丝状伪足。 通过电子显微镜,美国国家过敏和传染病研究所运营的落基山实验室的 Elizabeth R. Fischer 及其同事放大拍摄了有史以来第一张从这些结构中萌芽的病毒图像。
尽管已知其他病毒——包括埃博拉病毒、马尔堡病毒和牛痘病毒——会产生丝状伪足并将它们用作一种铁路,这些病毒可以沿着这条铁路到达其他细胞,但这是第一次观察到丝状伪足与冠状病毒家族的任何成员。 尽管仍有待证实,但科学家们认为 SARS-CoV-2 也可能使用丝状伪足作为感染性运输系统。
在确定了 SARS-CoV-2 赖以生存的激酶后,科学家们编制了一份已知针对许多这些激酶的现有药物清单。 如果这些药物能够成功干扰受感染细胞中的激酶活性,它们或许能够阻止病毒的传播。
科学家们测试了 68 种这样的化合物,发现那些干扰 CK2、p38/MAPK 和 CDK 通路活性的化合物表现出有效的抗病毒活性,而且对细胞没有毒性,这表明这些药物的组合“鸡尾酒”可能被证明是一种治疗 COVID-19 的有效方法。
QCRG 成员、加州大学旧金山分校细胞和分子药理学教授、该研究的共同资深作者 Kevan Shokat 博士说:“我们对靶向差异磷酸化蛋白的药物抑制细胞培养中的 SARS-CoV-2 感染的发现感到鼓舞。” “我们希望通过测试许多其他激酶抑制剂,同时使用其他技术进行实验,以识别可能有效干预 COVID-19 的潜在途径和其他潜在疗法,从而在这项工作的基础上再接再厉。”
除了加州大学旧金山分校、弗莱堡实验室和落基山实验室外,这项工作还包括来自英国剑桥欧洲分子生物学实验室欧洲生物科学研究所的研究人员; 纽约西奈山伊坎医学院; 和法国巴黎巴斯德研究所。 有关作者、单位和资金来源的完整列表,请参阅该研究。
媒体联络
杰森·阿尔瓦雷斯:jason.alvarez@ucsf.edu
安迪·默多克:andymurdock@berkeley.edu