Los equipos de investigación están desarrollando nuevas terapias para enfermedades neurodegenerativas y pruebas clínicas para ayudar a la aprobación de la FDA
Poco más de una década desde el desarrollo de CRISPR edición del genoma basado en CRISPR por innovador Genómica Jennifer Doudna, fundadora del instituto y colaboradora Emmanuelle Charpentier, los Institutos Nacionales de Salud (NIH) están utilizando su poder de financiación para incentivar a los investigadores a pensar más allá de las aplicaciones únicas de genoma, editar y desarrollar enfoques de plataforma que se pueden utilizar para abordar múltiples enfermedades. En dos premios por un total de $25 millones recién anunciados por los NIH Somático Celular Programa de edición del genoma (SCGE), los investigadores del IGI están desarrollando nuevos enfoques para tratar múltiples enfermedades neurodegenerativas, así como pruebas clínicas para ayudar a que las nuevas terapias basadas en CRISPR lleguen a los pacientes.
El primer proyecto, denominado “Corrección de Enfermedades Neurológicas vía Alelo Escisión específica de Patógeno Repeats” o “CASEPR” (pronunciado “case-per”), reúne a un grupo de expertos en edición del genoma CRISPR, medicina neurológica y requisitos normativos, con el objetivo de llegar a un ensayo clínico en cinco años. El equipo incluye a Jennifer Doudna, Fyodor Urnov, Niren Murthy, Petros Giannikopoulos y Ross Wilson en el IGI de UC Berkeley, Krystof Bankiewicz y Victor Van Laar de la Universidad Estatal de Ohio, y Claire Clelland en UC San Francisco.

Mientras que algunas enfermedades genéticas son causadas por un solo punto mutaciones donde se cambia una letra del código genético, varias enfermedades neurodegenerativas son causadas por un tipo diferente de mutación llamada "repetición de expansión" donde cadenas cortas de ADN El código se duplica accidentalmente cuando nuestras células copian o reparan el ADN. Estas pequeñas duplicaciones pueden transformar una copia sana de un gen en uno patógeno, particularmente si este error ocurre varias veces.
“En la enfermedad de Huntington, es una correlación muy clara. Hay un gen que contiene un número variable de copias de la secuencia 'CAG' (CAG, CAG, CAG, una y otra vez) si tienes demasiadas copias, te enfermas. Cuantas más copias tenga, más enfermo estará, más rápida será la progresión”, dice Ross Wilson, Director de Entrega Terapéutica del IGI.
El desafío en el diseño de una terapia genómica es que hay copias sanas y patógenas del gen en un paciente, por lo que una intervención de edición del genoma tiene que ser capaz de apuntar con precisión al gen con demasiadas copias repetidas y dejar intacto el gen sano. En el proyecto CASEPR, el equipo empleará una técnica CRISPR que se puede administrar in vivo y deshabilitará selectivamente las copias patógenas. El equipo se centrará en aplicar esta técnica a la enfermedad de Huntington y una forma común de esclerosis lateral amiotrófica (ELA), a veces llamada enfermedad de Lou Gehrig, con el objetivo de llegar a un ensayo clínico en cinco años.
El equipo comparará dos métodos diferentes para administrar las terapias CRISPR a las células afectadas utilizando virales vectores que se utilizan comúnmente en terapias genéticasy un enfoque no viral desarrollado en el IGI con el objetivo de crear una hoja de ruta para un enfoque seguro y reproducible que pueda aplicarse a otras enfermedades neurodegenerativas en el futuro.
Nuevas terapias, nuevas pruebas
A medida que más y más terapias basadas en CRISPR avanzan hacia la clínica, los investigadores y los reguladores necesitan formas confiables de evaluar la seguridad y eficacia de estas terapias. Pero debido a que la edición del genoma aún es tan nueva, las pruebas de grado clínico tienen que ponerse al día con el campo.

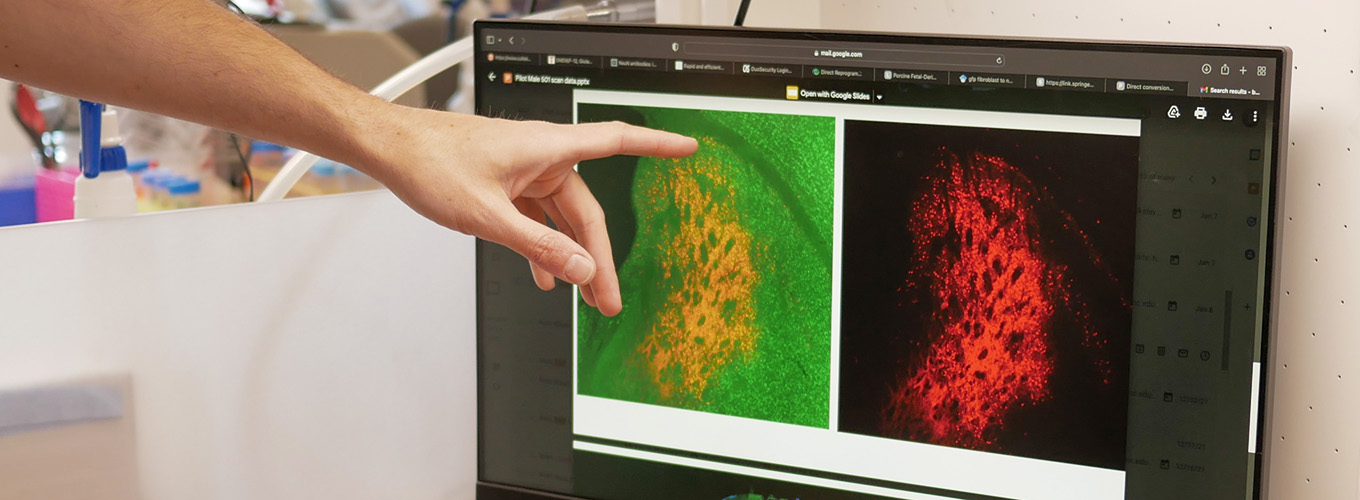
En un segundo proyecto que recibió un premio de 3 años a través del programa SCGE de los NIH, Petros Giannikopoulos, Director del Laboratorio Clínico IGI, está liderando un grupo que desarrolla una prueba de grado clínico que se puede aplicar en los múltiples ensayos en curso que utilizan la edición del genoma para tratar la enfermedad de células falciformes. Algunos grupos están adoptando el enfoque de usar CRISPR para reactivar una forma de hemoglobina que no se ve afectada por la mutación falciforme, mientras que otros, incluido el ensayo del consorcio UC en el que participa el IGI, están corrigiendo directamente la mutación subyacente. Si bien la generación actual de terapias ocurre ex vivo, o fuera del cuerpo, el objetivo de las terapias de próxima generación es administrarse in vivo, para que las terapias sean más accesibles y fáciles para los pacientes.
“Uno de los grandes desafíos en el campo es la falta de un método de consenso para evaluar el beneficio funcional de un tratamiento de células falciformes”, dice Giannikopoulos.
Actualmente, los investigadores prueban la efectividad de la edición del genoma al secuenciar el ADN después del tratamiento para medir qué fracción del ADN se ha corregido, pero esa no es una medición funcional directa de la enfermedad y sus efectos, lo cual es clave para los grupos que buscan FDA aprobación.
“La enfermedad de células falciformes causa problemas de muchas maneras diferentes. Hay una constelación de propiedades patológicas que adquiere un glóbulo rojo. Cuando corriges un células madre, lo que estás tratando de buscar es una pérdida de esas propiedades”, dice Giannikopoulos.
Para el nuevo proyecto, el equipo del IGI, en colaboración con Umut Gurkan en la Universidad Case Western Reserve, Mark Walters y Frans Kuypers en el UCSF Benioff Children's Hospital y la bióloga computacional de UC Berkeley, Nila Ioannidis, está desarrollando una nueva prueba compuesta utilizando un panel de ensayos para crear una prueba que se aplica sin importar cómo se realizó la edición del genoma. Estos incluyen ensayos de microfluidos de última generación que pueden probar propiedades como la adherencia y la flexibilidad de los glóbulos rojos, así como pruebas de cromatografía líquida que se han utilizado durante mucho tiempo para diagnosticar la enfermedad de células falciformes.
“No existe una aplicación excelente: estamos tratando de adoptar un enfoque integral. Nos sentimos muy bien de que esto sea factible, y tenemos toda la experiencia técnica y clínica para lograrlo”, dice Giannikopoulos. “Para cualquiera que esté trabajando en terapias de células falciformes, esta es una parte clave para que esas terapias lleguen a la meta regulatoria”.
Detalles del premio:
- Premio NIH 1U19NS132303-01 — Corrección de enfermedades neurológicas a través de la escisión específica de alelos de repeticiones patógenas
- Premio NIH 1U01AI176469-01 — Un ensayo de potencia independiente de la modalidad que permite terapias de edición del genoma tanto ex vivo como in vivo para la enfermedad de células falciformes
Contactos para los medios:
- Andy Murdock, Instituto de Genómica Innovadora — andymurdock@berkeley.edu