消息
T 细胞工程的突破回避了基因组编辑中对病毒的需求
IGI | 玛雅·科斯特曼 | 11 年 2018 月 XNUMX 日
T细胞工程的突破回避了基因编辑中对病毒的需求
加州大学旧金山分校新闻中心 | 皮特·法利 | 11 年 2018 月 XNUMX 日
有了更快、更便宜、更精确的技术,作者们说它是“走向新的竞赛” 手机 疗法
在一项对研究、医学和工业具有重大影响的成就中,加州大学旧金山分校的科学家们对人类免疫细胞进行了基因重编程,称为 T细胞 不使用 病毒 插入 的DNA. 研究人员表示,他们期待他们的技术——一种快速、通用且经济的方法,采用 CRISPR 基因- 编辑技术——在新兴的细胞治疗领域被广泛采用,加速开发新的更安全的治疗方法 癌症、自身免疫和其他疾病,包括罕见的遗传性疾病。
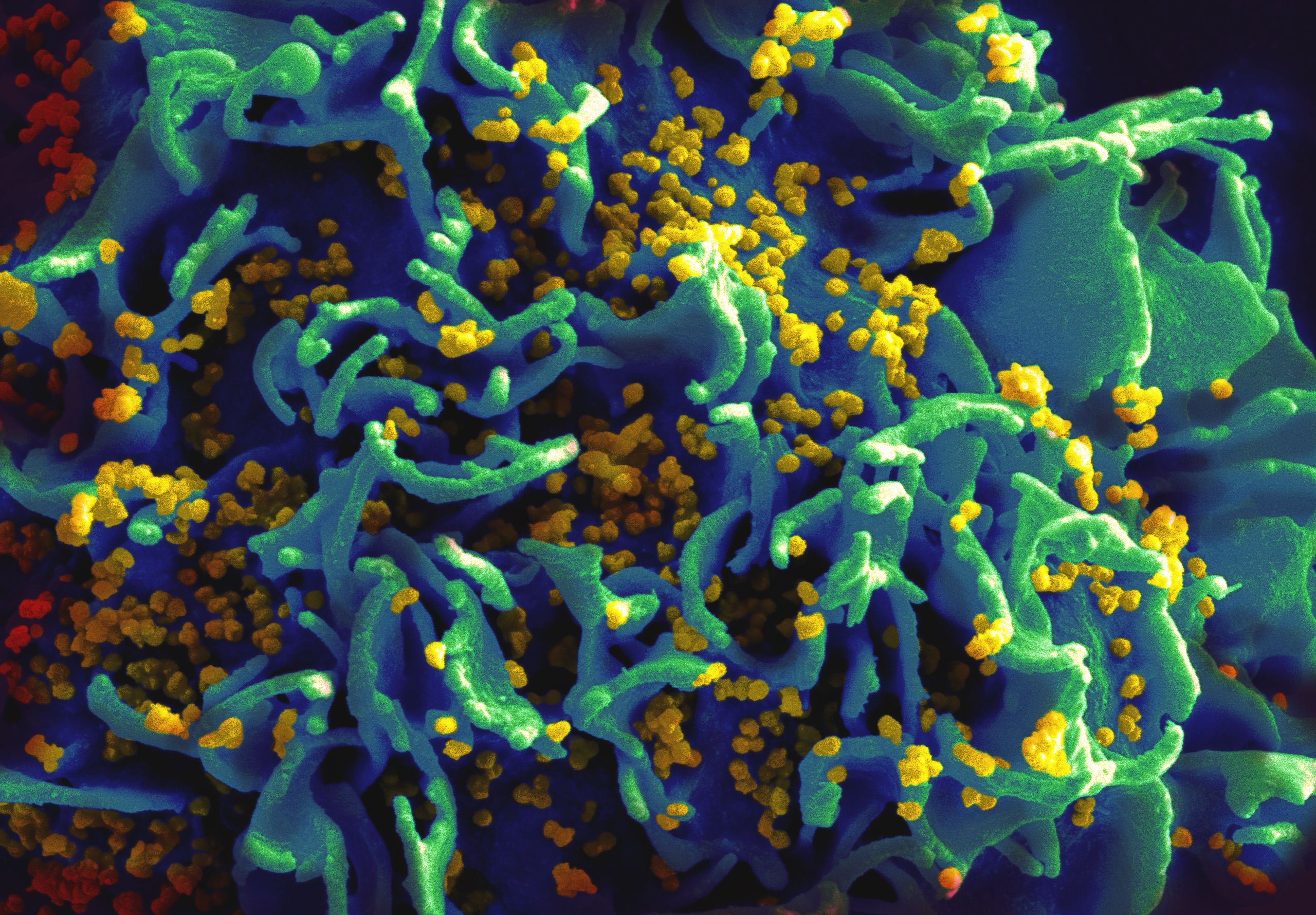
新方法, 在中描述 2018 年 7 月 11 日 发行 自然,提供强大的分子“剪切和粘贴”系统来重写 基因组 人类 T 细胞中的序列。 它依赖于电穿孔,这是一种将电场应用于细胞以使其膜暂时更具渗透性的过程。 加州大学旧金山分校的研究人员在一年的时间里对数千个变量进行了实验后发现,当一定数量的 T 细胞、DNA 和 CRISPR“剪刀”混合在一起,然后暴露在适当的电场中时,T 细胞将在这些元件中,并在基因组中的 CRISPR 编程切割位点精确整合特定的基因序列。
“这是一种快速、灵活的方法,可用于改变、增强和重新编程 T 细胞,因此我们可以赋予它们我们想要摧毁癌症、识别感染或抑制自身免疫性疾病中过度免疫反应的特异性,”加州大学旧金山分校的说 亚历克斯·马森, MD, PhD, 微生物学与免疫学副教授,委员 加州大学旧金山分校海伦迪勒家庭综合癌症中心,以及这项新研究的资深作者。 “现在我们开始了所有这些方面的比赛。”
但与新技术的速度和易用性同样重要的是,Marson 说,他也是 Innovative 的生物医学科学总监。 基因组学 研究所认为,这种方法可以将大量 DNA 插入 T 细胞,这可以赋予细胞强大的新特性。 马森实验室的成员已经 使用电穿孔和 CRISPR 取得一些成功 将少量遗传物质插入 T 细胞,但直到现在,许多研究人员多次尝试将长 DNA 序列放入 T 细胞,导致细胞死亡,导致大多数人相信大 DNA 序列对 T 细胞具有过度毒性。
为了证明新方法的多功能性和功效,研究人员用它来修复致病基因 突变 在来自具有罕见遗传形式自身免疫病的儿童的 T 细胞中,还创造了定制的 T 细胞来寻找和杀死人类黑色素瘤细胞。
病毒通过细胞膜注入自己的遗传物质引起感染,自 1970 年代以来,科学家们利用这种能力,剥离病毒的传染性特征,并使用由此产生的“病毒载体”将 DNA 输送到细胞中进行研究, 基因治疗,并在最近一个广为人知的例子中,创造了用于癌症免疫治疗的 CAR-T 细胞。
用病毒改造的 T 细胞现已获得美国食品和药物管理局的批准,用于对抗某些类型的白血病和淋巴瘤。 但是创建病毒载体是一个艰苦而昂贵的过程,而且临床级载体的短缺导致基因疗法和基于细胞的疗法的制造瓶颈。 即使可用,病毒载体也远非理想,因为它们将基因随意插入细胞基因组中,这可能会破坏现有的健康基因或使新引入的基因不受确保细胞正常功能的调控机制的控制。 这些限制可能导致严重的副作用,已引起基因治疗和细胞治疗(如基于 CAR-T 的免疫治疗)的关注。
“已经有三十年的工作试图将新基因导入 T 细胞,”第一作者西奥罗斯说,他是加州大学旧金山分校攻读医学博士和博士学位的学生。 医学科学家培训计划 谁设计并领导了马森实验室的新研究。 “现在应该不再需要让六七个人在一个实验室里研究病毒来设计 T 细胞,如果我们开始看到数百个实验室在改造这些细胞,而不是仅仅几个,并且与越来越多的人一起工作复杂的 DNA 序列,我们将尝试更多的可能性,这将显着加快未来几代细胞疗法的发展。”
经过近一年的反复试验,Roth 确定了 T 细胞群、DNA 数量和 CRISPR 丰度的比率,结合提供适当参数的电场,将导致有效和准确地编辑 T 细胞'基因组。
为了验证这些发现,Roth 指导 CRISPR 标记一系列不同的 T 细胞 蛋白质 与绿色荧光蛋白 (GFP),结果是高度特异性的,具有非常低水平的“不中” 效果:每个亚细胞结构 Roth's CRISPR-Cas9 模板被设计为用 GFP 标记——没有其他模板——在显微镜下发出绿光。
然后,在 补充 Roth、Marson 和他的同事们设计的实验旨在作为新技术治疗前景的原理证明,展示了它如何有可能用于组织 T 细胞对抗自身免疫性疾病或癌症。
在第一个例子中,Roth 及其同事使用了耶鲁大学医学院医学博士 Kevan Herold 提供给马森实验室的 T 细胞。 这些细胞来自患有罕见的严重自身免疫性疾病的三个兄弟姐妹,这种疾病迄今为止对治疗有抵抗力。 基因组测序表明,这些儿童的 T 细胞携带一种名为 IL2RA. 该基因包含对调节性 T 细胞或 Treg 发育必不可少的细胞表面受体的指令,Treg 可控制其他免疫细胞并防止自身免疫。
借助非病毒 CRISPR 技术,加州大学旧金山分校的团队能够快速修复 IL2RA 儿童 T 细胞的缺陷,并恢复因突变而受损的细胞信号。 在CAR-T疗法中,已经从体内取出的T细胞经过改造以增强其抗癌能力,然后返回体内以靶向肿瘤。 研究人员希望类似的方法可以有效治疗 Tregs 功能障碍的自身免疫性疾病,例如在三个患有 IL2RA 突变。
在与加州大学洛杉矶分校帕克癌症免疫治疗研究所的 Cristina Puig-Saus 博士和医学博士 Antoni Ribas 合作进行的第二组实验中,科学家们用专门设计用于寻找特定亚型人类黑色素瘤细胞的新受体。 T 细胞受体是细胞用来检测疾病或感染的传感器,在实验室培养皿中,工程细胞有效地定位在目标黑色素瘤细胞上,同时忽略其他细胞,表现出一种特异性,这是精准癌症医学的主要目标。
在不使用病毒的情况下,研究人员能够产生大量经 CRISPR 改造的细胞,这些细胞重新编程以展示新的 T 细胞受体。 当转移到植入了人类黑色素瘤的小鼠体内时,经过改造的人类 T 细胞会进入肿瘤部位并显示出抗癌活性。
“这种替换 T 细胞受体的策略可以推广到任何 T 细胞受体,”马森说,他也是 帕克癌症免疫治疗研究所 在 UCSF 和 Chan Zuckerberg Biohub 调查员。 “通过这项新技术,我们可以剪切并粘贴到指定的位置,重写基因组序列中的特定页面。”
Roth 说,因为这项新技术可以在一周多一点的时间内创建可行的定制 T 细胞系,它已经改变了 Marson 实验室的研究环境。 由于病毒载体带来的障碍,以前认为太困难或太昂贵的实验想法现在已经成熟,可供研究。 “我们将研究 20 个‘疯狂’的想法,”Roth 说,“因为我们可以非常快速地创建 CRISPR 模板,而且一旦我们有了模板,我们就可以将其导入 T 细胞并使其快速生长。”
Marson 将新方法的成功归功于 Roth 的“绝对毅力”,因为人们普遍认为病毒载体是必要的,T 细胞只能耐受一小段 DNA。 “Theo 坚信,如果我们能够找出合适的条件,我们就可以克服这些感知到的局限性,他付出了巨大的努力来测试数千种不同的条件:CRISPR 与 DNA 的比率; 培养细胞的不同方式; 不同的电流。 通过优化这些参数中的每一个并将最佳条件放在一起,他能够看到这个惊人的结果。”
除了加州大学旧金山分校、耶鲁大学医学院和加州大学洛杉矶分校的研究人员外,这项工作是与马里兰州弗雷德里克国家癌症研究所的科学家合作进行的; 斯坦福大学; 芝加哥大学; 宝生物; 陈扎克伯格生物中心; 内布拉斯加大学; 费城儿童医院; 和宾夕法尼亚大学。
有关完整的作者列表以及资助信息,请在线查看已发表的研究。 Marson 是 Spotlight Therapeutics 的联合创始人,并担任 Juno Therapeutics 和 PACT Pharma 的顾问。 马森实验室获得了朱诺、Epinomics 和赛诺菲的赞助资金,以及吉利德科学的礼物。 Roth、Puig-Saus、Eric Shifrut 博士、Ribas 和 Marson 是与这项研究相关的新专利申请的发明人。