noticias
Investigadores crean nuevo sistema para pruebas y desarrollo de impulsores genéticos más seguros
El sistema de piratería convierte los impulsores genéticos divididos en impulsores completos, lo que ofrece una nueva flexibilidad de experimentación... Pero también revela sorprendentes costos de aptitud de los sistemas de impulsos completos
Los científicos siguen ampliando las fronteras tecnológicas de CRISPR, junto con su enorme potencial, en áreas que van desde la salud humana hasta el suministro mundial de alimentos. Tal es el caso de las tecnologías basadas en CRISPR. impulsos genéticos, edición genética herramienta diseñada para influir en cómo los elementos genéticos se transmiten de una generación a la siguiente.
Gene Las unidades diseñadas para mosquitos tienen el potencial de frenar la propagación de infecciones de malaria que causan cientos de miles de muertes cada año, sin embargo, se han planteado problemas de seguridad ya que tales unidades pueden propagarse rápidamente y dominar poblaciones enteras. Los científicos han explorado los principios que rigen la propagación de elementos impulsores genéticos en poblaciones objetivo, como los mosquitos, probando muchas combinaciones diferentes de componentes que constituyen el aparato impulsor. Sin embargo, han descubierto que aún hay más por explorar y quedan preguntas clave.
En la revista Nature Communications, Investigadores de UC San Diego dirigidos por el ex becario postdoctoral Gerard Terradas junto con el becario postdoctoral Zhiqian Li y el profesor Ethan Bier, en estrecha colaboración con los investigadores del IGI Jared Bennett y el profesor John Marshall, describen el desarrollo de un nuevo sistema para probar y desarrollar impulsores genéticos en el laboratorio y convertirlos de forma segura en herramientas para aplicaciones potenciales en el mundo real.
"Estos estudios potencian la nueva ingeniería de los sistemas de impulsores genéticos al tiempo que brindan información importante sobre cómo evaluar y analizar las interacciones clave entre sus partes móviles más importantes", dijo Bier, miembro de la facultad de la Facultad de Ciencias Biológicas de UCSD, Departamento de Celular y Biología del Desarrollo.
Los impulsores genéticos basados en CRISPR presentan una proteína llamado a Cas9 endonucleasa y un ARN guía molécula que unen sus fuerzas para dirigir ADN cortes a sitios específicos en el genoma, donde se pueden insertar nuevos elementos genéticos. A medida que el ADN repara estos cortes, los nuevos elementos genéticos se copian de uno cromosoma a otro, dando como resultado una descendencia que excede el 50-50 por ciento estándar de herencia, favoreciendo en cambio los elementos genéticos recién insertados.
Los impulsores genéticos vienen en dos "sabores". Los impulsores genéticos completos (fGD) llevan el Cas9 y la guía moléculas de ARN componentes en un paquete unitario vinculado. A diferencia de, unidades divididas (sGD) consisten en dos elementos genéticos que llevan por separado el Cas9 y guían los componentes del ARN y se insertan en diferentes sitios del genoma. Los sGD se consideran más seguros que los fGD, ya que es posible controlar y probar los componentes que lleva cada uno de los elementos por separado o en condiciones en las que amplifican gradualmente la frecuencia del componente gRNA. Los investigadores diseñan los dos elementos para que finalmente se vuelvan a conectar con el fin de generar los efectos de un impulso genético completo.
Estos estudios potencian la nueva ingeniería de los sistemas de impulsores genéticos al tiempo que brindan información importante sobre cómo evaluar y analizar las interacciones clave entre sus partes móviles más importantes.
En el caso de la erradicación de la malaria, los impulsores genéticos completos han generado un gran entusiasmo debido a su potencial como vehículos para transferir elementos que detienen la transmisión de los parásitos de la malaria que causan la infección. Pero los fGD también han generado preocupaciones debido a su potencial para propagarse rápidamente y potencialmente alterar la composición genética de poblaciones enteras de mosquitos. Experimentar con fGD requiere barreras y restricciones de alta seguridad para evitar el escape no intencionado de insectos que transportan tales unidades al entorno abierto.
Este no es el caso de los impulsores genéticos divididos. Debido a que los elementos clave están separados, los sGD conllevan mucho menos riesgo de propagación involuntaria y los investigadores tienen mucho más control para su manipulación segura. Los experimentos con sGD se pueden realizar en instalaciones de laboratorio tradicionales, lo que permite mucha más flexibilidad para probar su potencial.
Sin embargo, los científicos se han enfrentado al desafío de desarrollar sistemas que conviertan efectivamente los sGD en fGD completamente funcionales. Un desafío que enfrenta la conversión actual de los sistemas sGD en fGD es que se basan en dos componentes genéticos separados, cada uno de los cuales debe manifestar propiedades de conducción eficientes.

Ahora, los científicos de la UC que recientemente han sido pioneros en el desarrollo de impulsores genéticos y tecnologías relacionadas han creado un sistema de "piratería" genética flexible para convertir sGD en fGD. Trabajando en moscas de la fruta, los investigadores desarrollaron una nueva estrategia genética que emplea un ARN guía especialmente diseñado que lleva la parte Cas9 de la sGD. Esta herramienta de piratería corta el componente de copia del sGD y desencadena un intercambio genético, o "evento de recombinación", que inserta el Cas9 en el elemento que lleva el ARN guía, lo que da como resultado la creación de un fGD completamente funcional.
“En primer lugar, y lo más importante, el estudio proporciona una prueba de principio para la conversión genética ágil de un sGD en un fGD, lo que debería ser de gran ayuda en la prueba y el desarrollo de nuevos sistemas optimizados de impulso genético”, dijo el primer autor del artículo, Terradas. , que ahora trabaja en la Universidad de Penn State.
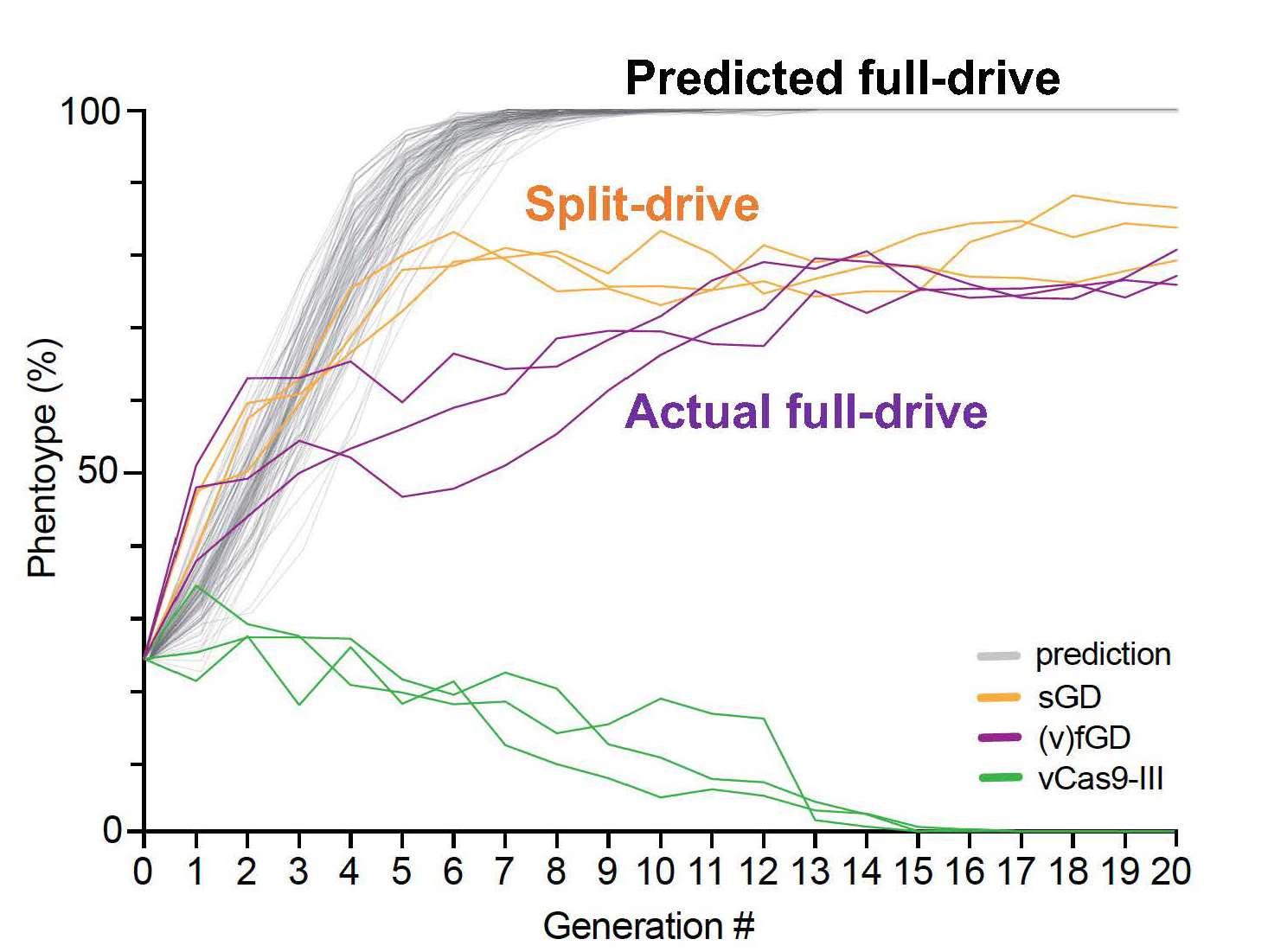
Una vez que los investigadores desarrollaron su nuevo sistema de pirateo de sGD a fGD, comenzaron a surgir algunos resultados sorprendentes. El fGD recién pirateado se propagó a través de poblaciones de moscas en experimentos con jaulas, como se esperaba. Sin embargo, la velocidad a la que se propagó fue inesperadamente más lenta de lo que habían predicho los modelos para un fGD tradicional.
Los investigadores del IGI, Bennett y Marshall, que trabajan en la Universidad de California en Berkeley, desarrollaron un modelo matemático que proporcionó una explicación. Su modelo reveló que durante la conversión de pirateo, los fGD imponen un mayor costo de aptitud en moscas individuales que los sGD solos. Este costo de adecuación, que se desarrolla cuando el elemento impulsor se copia a sí mismo, desapareció después de actuar sobre todos los cromosomas diana potenciales de la población.
“El estudio revela complejidades imprevistas en la forma en que los componentes del impulso genético funcionan juntos, lo que revela que uno no puede simplemente suponer cómo pueden interactuar los componentes separados cuando se juntan”, dijo Bennett.
La Nature Communications lista completa de autores del artículo: Gerard Terradas, Jared Bennett, Zhiqian Li, John Marshall y Ethan Bier.
La investigación fue apoyada por: Un premio Paul G. Allen Frontiers Group Distinguished Investigators Award, los Institutos Nacionales de Salud (subvención R01GM117321), un obsequio de Tata Trusts en India al Tata Institute for Genetics and Society - UC San Diego y un DARPA Subvención del programa Safe Genes (HR0011-17-2-0047).
Divulgación de intereses en competencia: Bier tiene participación accionaria en dos empresas que cofundó: Synbal Inc. y Agragene, Inc., que pueden beneficiarse potencialmente de los resultados de la investigación. También es miembro de la junta directiva de Synbal y de la junta asesora científica de ambas empresas.
Este artículo fue publicado originalmente por Noticias de UC San Diego.
Contactos para los medios:
Andy Murdock, andymurdock@berkeley.edu
Mario Aguilera, maguilera@ucsd.edu