
*Consulte nuestra revisión de ensayos clínicos de 2023 esta página.
Con el reciente rumor sobre CRISPR ensayos clínicos, pensamos que había llegado el momento de realizar una actualización completa del estado. Puede ser difícil hacer un seguimiento de todos los diferentes ensayos, especialmente porque muchas de las mismas enfermedades aparecen en las noticias a medida que los investigadores prueban diferentes enfoques de tratamiento. En esta publicación, le presentaré los conceptos básicos de los ensayos clínicos y luego trazaré un mapa de los ensayos actuales basados en CRISPR desde los antecedentes de la enfermedad hasta las actualizaciones del progreso y lo que realmente esperamos aprender de estos ensayos.
Conceptos básicos de los ensayos clínicos
En los Estados Unidos, la Administración de Alimentos y Medicamentos (FDA) prueba la seguridad y eficacia de nuevos tratamientos para enfermedades a través de ensayos clínicos en pacientes voluntarios. Los primeros ensayos analizan la seguridad y los efectos secundarios, mientras que los ensayos posteriores prueban la eficacia y comparan nuevas terapias con el tratamiento estándar.s.
Los ensayos actuales que utilizan terapias CRISPR se encuentran todos en las primeras etapas. Eso significa que incluso si tienen éxito, probablemente aún falten algunos años para la aprobación de la FDA.
Se están realizando ensayos clínicos en tres áreas de tratamiento: cánceres, trastornos sanguíneos y enfermedades oculares. Todos los ensayos clínicos actuales de CRISPR están destinados a editar los tejidos específicos sin afectar a los espermatozoides ni a los óvulos, lo que significa que no ADN los cambios pueden transmitirse a las generaciones futuras.
CÁNCERES
Antecedentes de la enfermedad
El cáncer se refiere a un grupo de enfermedades que involucran incontrolables (SCD por sus siglas en inglés), crecimiento. En este momento, las terapias basadas en CRISPR están dirigidas principalmente a tratar cánceres de la sangre como leucemia y linfoma.
Estrategia de tratamiento
las células T, más conocidos como glóbulos blancos, están cubiertos de receptores que reconocen a otras células como seguras o amenazadoras. Patrullan el cuerpo, matando células extrañas o peligrosas. En CAR-T En inmunoterapia, los investigadores diseñan genéticamente las células T de un paciente para que tengan un receptor que reconozca las células cancerosas del paciente y les indique que ataquen.
El sistema inmunológico está altamente regulado para evitar atacar las células sanas. Algunos receptores de células T funcionan como "puntos de control" que determinan si se produce una respuesta inmunológica. Cuando un receptor de células T PD-1 entra en contacto con una molécula llamada PD-L1 en otra célula, comunica que es una célula "segura" y la célula T la deja en paz.
Las células cancerosas son inteligentes y, a menudo, se ocultan en estas señales de seguridad molecular, engañando a las células T que patrullan para que las ignoren. Los investigadores están usando CRISPR para editar el PD-1 gen en las células T para evitar que produzcan receptores PD-1 funcionales para que no puedan ser engañados por las células cancerosas. Este enfoque de inmunoterapia se conoce como inhibición del punto de control y se usa junto con la ingeniería CAR-T para brindar a las células T la mayor posibilidad posible de eliminar el cáncer.
En estos tratamientos, los investigadores recolectan células T de la sangre de un paciente y las diseñan en un laboratorio. Esta es una especie de ex vivo edición del genoma basado en CRISPR, Debido a que el genoma, la edición ocurre fuera del cuerpo del paciente. Ex vivo la edición garantiza que las herramientas de edición del genoma solo entren en contacto con las células diana correctas.
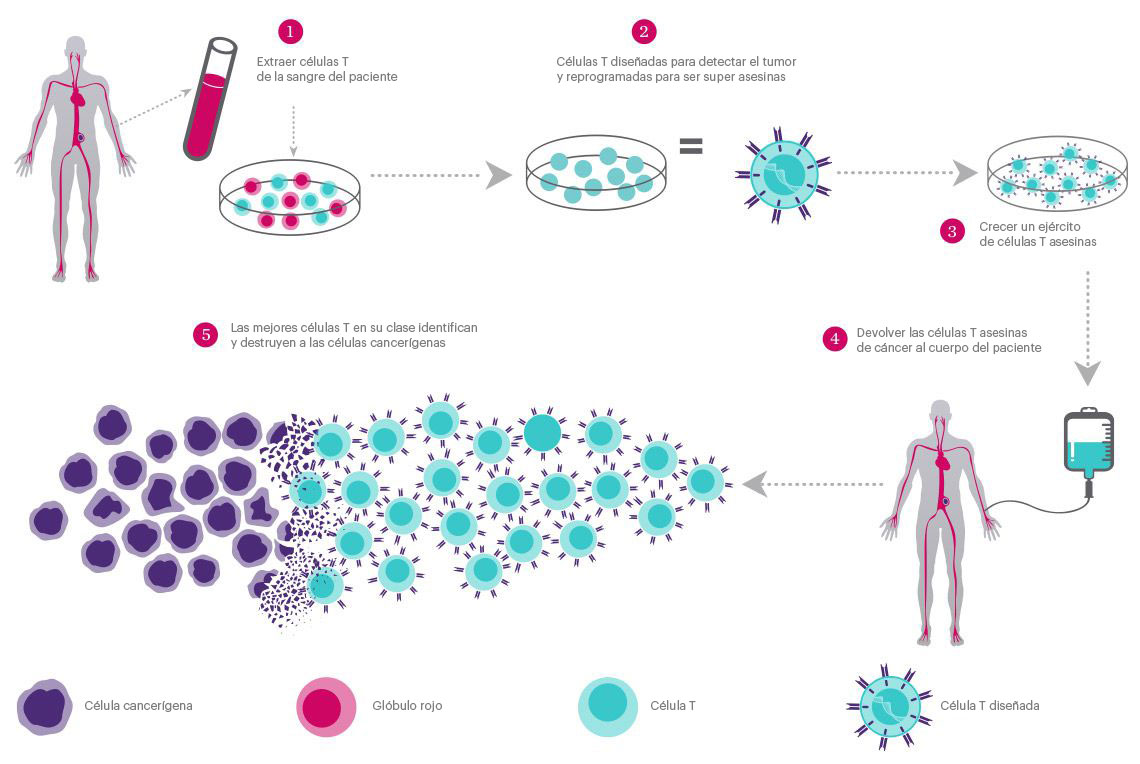
Uno de los grandes desafíos para las terapias genéticas es la entrega, es decir, llevar el medicamento donde debe estar y solo donde debe estar. Los cánceres de sangre son algunos de los primeros objetivos de las terapias CRISPR porque la administración es la más sencilla. Las células T modificadas se pueden enviar a la sangre por vía intravenosa, como recibir una transfusión de sangre.
Ensayos clínicos actuales
La primer ensayo de terapia basada en CRISPR en los EE. UU. combina enfoques de inmunoterapia CAR-T y PD-1. Esta estudio está actualmente en curso en la Universidad de Pensilvania, en conjunto con el Instituto Parker. Los pacientes voluntarios tienen cánceres en etapa tardía y pocas otras opciones de tratamiento. Por lo menos dos pacientes han sido tratados, pero aún no conocemos los resultados.
Los ensayos clínicos que prueban inmunoterapias CRISPR para tratar el cáncer pueden haber comenzado ya en 2015 en China. Siete ensayos activos o de reclutamiento en China se enumeran en el ensayo clínico de EE. UU. base de datos. Mientras que China es Invertir fuertemente en CRISPR, existe una gran preocupación de que los médicos avancen sin un ensayo clínico adecuado infraestructura, supervisión, precauciones de seguridad, consentimiento informado de pacientes, o investigación estrictamente. China ha tenido repetidos problemas con fraudulento datos de ensayos clínicos. Se han publicado pocos datos de estudios activos o completados.
A qué mirar
La FDA ya ha aprobado CAR-T terapias e inhibidores de la vía PD-1 que no utilizan la edición del genoma. Esta es una razón para ser optimistas: el trabajo de prueba de principio para estas terapias ya se ha realizado.
Dicho esto, todavía hay mucho que tener en cuenta. Si bien hay tratamientos con anticuerpos disponibles para desactivar PD-1, no se ha probado la eficacia de la edición de ADN para desactivar el gen PD-1. ¿En qué porcentaje de células funcionará? ¿Funcionará la inhibición de puntos de control genéticos tan bien como los tratamientos actuales de bloqueo de puntos de control?
Estos ensayos también deberían proporcionar información sobre cuestiones más amplias sobre la edición basada en CRISPR: qué tipo de cambios ocurrirán en el sitio de la rotura del ADN que Cas9 crea? Con que frecuencia veremos reordenamientos de ADN más grandes ¿que lo esperado? ¿Habrá importantes "fuera del objetivo" ¿cambios? ¿Estos riesgos resultarán más o menos importantes que los beneficios?
TRASTORNOS DE LA SANGRE
Antecedentes de la enfermedad
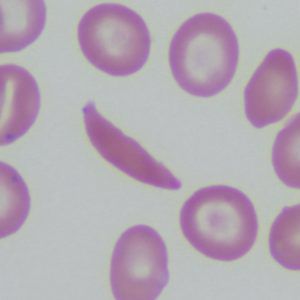
Los glóbulos rojos utilizan la hemoglobina para recoger oxígeno en los pulmones y transportarlo a todos los tejidos del cuerpo. Las mutaciones en un gen que forma parte de la molécula de hemoglobina causan dos trastornos genéticos diferentes: beta talasemia y enfermedad de células falciformes (ECF).
En la beta talasemia, los pacientes no producen suficiente hemoglobina. Esto conduce a anemia y fatiga. En los casos más graves, los pacientes tienen daños en los órganos, especialmente en el hígado, los huesos y el corazón. En la anemia de células falciformes (ECF), los glóbulos rojos se deforman. Su forma de media luna o hoz hace que bloqueen los vasos sanguíneos, lo que ralentiza o detiene el flujo sanguíneo. Esto provoca un dolor intenso y repentino. Las complicaciones incluyen dolor crónico, daño orgánico, accidentes cerebrovasculares y anemia. Ambas enfermedades pueden ser fatales.
Hay algunos tratamientos disponibles, pero estos pacientes todavía sufren a menudo síntomas graves y complicaciones de sus enfermedades. Los pacientes necesitan transfusiones de sangre frecuentes. El trasplante de médula ósea puede ser curativo; sin embargo, este es un procedimiento riesgoso y solo se puede realizar cuando se puede encontrar un donante compatible y sano. Esta no es una opción para la mayoría de los pacientes con beta talasemia o SCD.
Estrategia de tratamiento
Los ensayos clínicos actuales de CRISPR para trastornos sanguíneos utilizan una solución inteligente: en lugar de corregir la enfermedad,que causan mutaciones, tienen como objetivo aumentar los niveles de hemoglobina fetal. Ésta es una forma de hemoglobina que los fetos producen en el útero, pero que los niños y los adultos no suelen producirla. No sabemos por qué los humanos cambian de una forma de hemoglobina a otra, pero la hemoglobina fetal puede tomar el lugar de hemoglobina adulta defectuosa en los glóbulos rojos.
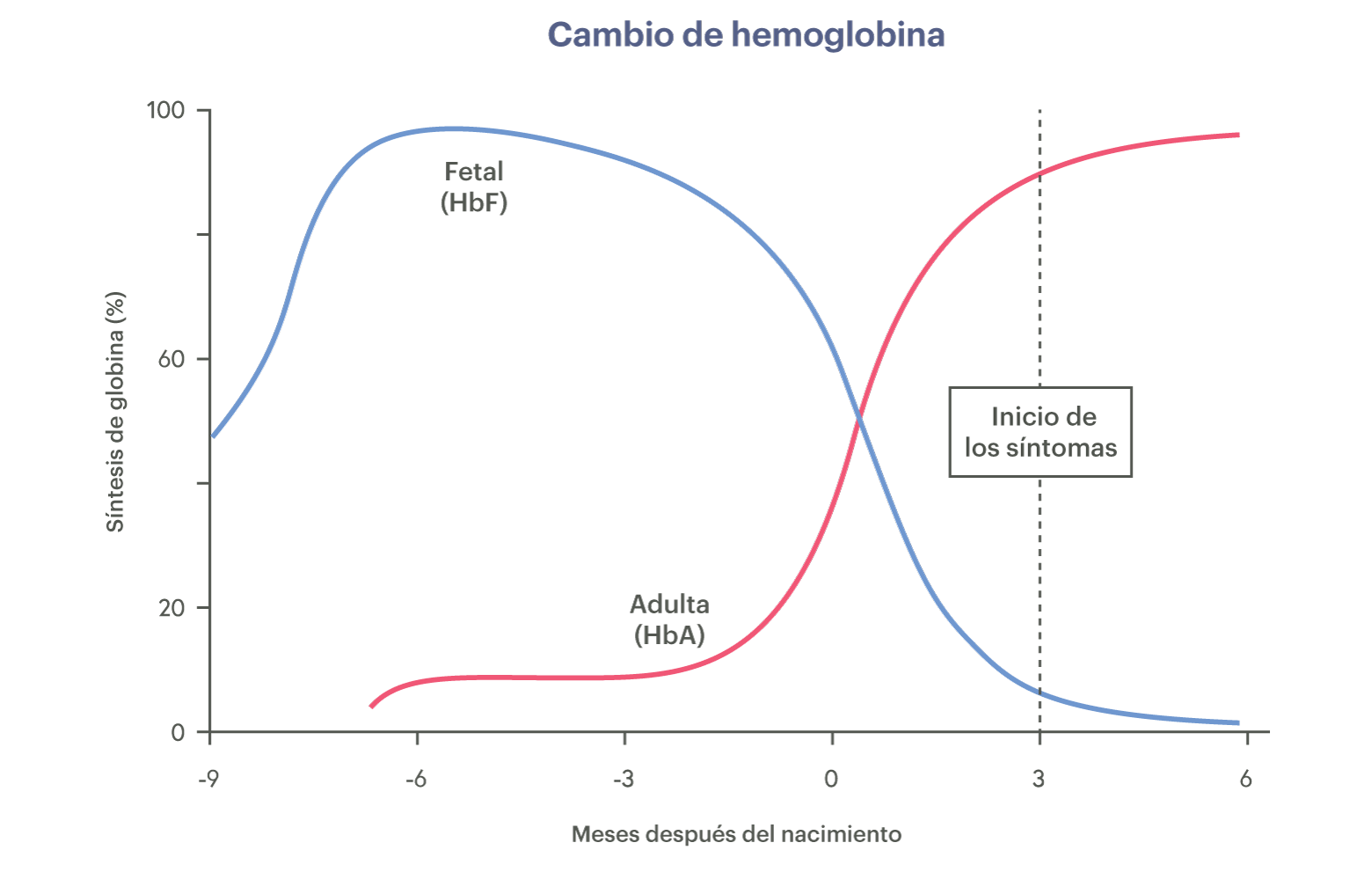
El mismo tratamiento genético dirigido a la hemoglobina fetal se puede utilizar para tratar la beta talasemia y la ECF. El primer paso de este tratamiento es extraer la sangre de un paciente. células madre de su sangre. A continuación, los científicos editan los genomas de estas células para activar la hemoglobina fetal. Luego, la quimioterapia elimina las células madre defectuosas restantes del paciente y miles de millones de células madre editadas del genoma se devuelven al cuerpo del paciente. Idealmente, estas células crearán una nueva población de células madre sanguíneas en la médula ósea, que producirá glóbulos rojos con hemoglobina fetal.
Las células madre sanguíneas editadas genéticamente se pueden administrar por vía intravenosa, y ex vivo la edición facilita la entrega de herramientas de edición del genoma a las células objetivo.
Pruebas
En primer uso de un ex vivo Terapia basada en CRISPR para tratar una enfermedad genética, los investigadores han tratado al menos un paciente con beta talasemia en Alemania. CRISPR Therapeutics y Vertex Pharmaceuticals están ejecutando esta prueba y reclutamiento pacientes en Europa y Canadá. Terapéutica CRISPR recientemente reveló que las celdas editadas parecen estar funcionando en su primer paciente.
En primer uso de un ex vivo Terapia basada en CRISPR para tratar una enfermedad genética en los EE. UU., Al menos un paciente con SCD ha sido tratado con la misma terapia en Nashville, Tennessee. Los primeros datos de este participante parecen prometedores; puedes seguir las actualizaciones esta página. juicio está reclutando en los EE. UU., Europa y Canadá.
A qué mirar
En este momento, no sabemos qué tan efectivos serán estos tratamientos. Los resultados clave a tener en cuenta incluyen: ¿qué porcentaje de celdas se editó correctamente? ¿Qué tan bien hacen las células madre editadas un nuevo hogar en la médula ósea? ¿Las células editadas producirán suficiente hemoglobina fetal para controlar la enfermedad de un paciente? Con el tiempo, ¿las células madre sanguíneas con la edición persistirán o serán reemplazadas por células con las mutaciones causantes de la enfermedad?
En este momento, hay una gran cantidad de investigaciones sobre los trastornos sanguíneos. Otras empresas farmacéuticas y de biotecnología están trabajando tanto en terapias estándar como genéticas. Aún no sabemos qué enfoques serán más efectivos, pero los pacientes seguramente se beneficiarán al renovar el interés en estas enfermedades.
ENFERMEDAD OCULAR
Antecedentes de la enfermedad
La amaurosis congénita de Leber (LCA) es la causa más común de ceguera infantil hereditaria. LCA10 es la forma más común de LCA. Esta enfermedad genética causa una pérdida severa de la visión o ceguera durante los primeros meses de vida.
Las células fotorreceptoras del ojo convierten la luz en señales nerviosas que viajan al cerebro. En LCA10, una mutación en un gen fotorreceptor crea una versión abreviada y defectuosa de un proteína, lo que hace que las células fotorreceptoras sean disfuncionales. Los pacientes con LCA10 pueden recibir luz en el ojo, pero las células fotorreceptoras disfuncionales no envían mensajes al cerebro. Sin comunicación entre los ojos y el cerebro, los pacientes tienen pérdida de visión o ceguera.
Estrategia de tratamiento
El tratamiento CRISPR para LCA10 realiza un cambio en el gen fotorreceptor defectuoso del paciente para que, una vez más, produzca una proteína funcional de tamaño completo en lugar de la versión corta y rota. Si se editan suficientes células y pueden producir la proteína saludable, los pacientes deberían recuperar la visión.
Los investigadores darán a los pacientes voluntarios una dosis única de la terapia CRISPR inyectándola directamente en el ojo del paciente. La inyección tiene un efecto no patógeno. virus (AAV) que lleva la proteína Cas9 y su un ARN guía. Los virus se utilizan comúnmente en terapias de genes y edición del genoma porque tienen una capacidad natural para ingresar a las células. Para el tratamiento LCA10, el virales El vector está diseñado para que la terapia sea activa solo en las células fotorreceptoras.
Este enfoque es distinto de los que se están probando para detectar cáncer y trastornos sanguíneos porque es un in vivo tratamiento, donde la edición del genoma ocurre dentro del cuerpo del paciente. En comparación con ex vivo edición, in vivo la edición tiene mayores desafíos y riesgos. Uno de los mayores riesgos es que las herramientas de distribución viral o las partes de edición del genoma provoquen reacciones inmunes peligrosas en un paciente. Otro gran desafío es asegurarse de que CRISPR enzimas CRISPR-Cas no se quede demasiado tiempo, ya que eso les daría una mayor probabilidad de cortar en lugares no deseados del ADN.
Puede ser un poco aprensivo al pensar en agujas cerca de los ojos, pero el ojo es en realidad un órgano ideal para in vivo edición.
Es relativamente pequeño, por lo que solo requiere un tratamiento de dosis única de pequeño volumen. El ojo tiene menos reactividad inmune en comparación con la mayoría de los tejidos, lo que hace que sea menos probable que se produzca una reacción inmunitaria peligrosa. Debido a que el ojo está relativamente contenido, es poco probable que los componentes de CRISPR viajen a otras partes del cuerpo, por lo que hay menos riesgo de edición no deseada del genoma o respuestas inmunes en otros tejidos.
Ici
La FDA ha aprobado las pruebas en humanos de este tratamiento con LCA10. Esto será la primera in vivo Ensayo de terapia CRISPR. Editas Medicine está ejecutando esto juicio en colaboración con Allergan, y actualmente están reclutando pacientes voluntarios en todo EE. UU.
A qué mirar
Los investigadores deberán seguir de cerca a los pacientes para ver si otras células las células fotorreceptoras se ven afectadas, o si los pacientes tienen reacciones inmunes contra el tratamiento. Otras preguntas clave de investigación incluyen: ¿qué porcentaje de celdas se editarán de manera efectiva? ¿Será suficiente para restaurar la visión?
Si el tratamiento funciona, esta será la primera demostración de una solución directa para una enfermedad genética. Las terapias genéticas tradicionales, como las de "Enfermedad del chico burbuja" funcionan agregando un gen adicional, no reparando el gen defectuoso original. Del mismo modo, las terapias CRISPR para la beta talasemia y la SCD no corrigen la mutación original que causa la enfermedad. El éxito de este ensayo sería un gran paso adelante en la medicina genética.
EL GRAN IMAGEN: LO QUE ESPERAMOS APRENDER DE ESTAS PRUEBAS

En conjunto, estos ensayos deberían ayudar a los científicos a conocer los tipos de Cambios de ADN que las enzimas CRISPR provocan en una variedad de diferentes tipos de tejidos, utilizando diferentes métodos de administración. ¿Hay cambios no deseados, como la eliminación de grandes extensiones de ADN o la reorganización de fragmentos de cromosomas? Podemos suponer que se producirán cambios no deseados en algún nivel, pero ¿tendrán un efecto significativo en los pacientes? ¿Qué importancia tendrán estos problemas en comparación con la gravedad de las enfermedades que se tratan?
Lo que estos ensayos tienen en común son las opciones de administración fáciles y un bajo riesgo de una respuesta inmune peligrosa a los componentes de CRISPR; estas terapias son las primeras porque existen soluciones convenientes para estos desafíos técnicos. ¿Qué es lo siguiente?
Más CRISPR médicos primeros a tener en cuenta
Si bien estos ensayos son emocionantes, existe un precedente para las inmunoterapias contra el cáncer y para el tratamiento de trastornos de la sangre mediante el aumento de hemoglobina fetal- estos no son enfoques de tratamiento fundamentalmente nuevos que dependen del uso de CRISPR. Además, confían en realizar ediciones en el ADN que son bastante fáciles para CRISPR-Proteínas Cas enzimas: en realidad, no son pruebas importantes de lo que puede hacer la tecnología CRISPR en sí. En términos de comprender los mayores alcances del potencial de CRISPR, aprenderemos mucho de los hitos futuros:
- A Tratamiento CRISPR que implica la inserción de ADN para reparar o reemplazar una secuencia defectuosa: "pegar" en material nuevo sigue siendo un gran desafío.
- A ensayo en el que se utilizan herramientas CRISPR para activar y desactivar genes sin editar el ADN. Estas estrategias, conocidas como Activación e inhibición de CRISPR, no requieren romper el ADN de un paciente, por lo que podrían estar más seguros. Sin embargo, no está claro cuánto tiempo durarán sus efectos en los seres humanos.
- A Terapia CRISPR que repara múltiples genes a la vez. Muchas afecciones importantes, como la diabetes y las enfermedades cardíacas, son "enfermedades poligénicas, ”Lo que significa que múltiples genes juegan un papel en su progresión. Mientras que los científicos han logrado hazañas impresionantes en aislado células y modelos animales, estamos muy lejos de realizar múltiples cambios en el genoma de pacientes reales.
- An in vivo Ensayo CRISPR que utiliza entrega no viral- las tecnologías actuales se basan en la liberación viral, que puede desencadenar reacciones inmunes o inserciones no deseadas de ADN viral en el genoma. La pequeña capacidad de carga de estos virus también limita lo que se puede hacer, ya que un solo gen de la enzima CRISPR más su guía moléculas de ARN generalmente ocupan la mayor parte del espacio de carga. Los investigadores están desarrollando estrategias de entrega alternativas, a partir de nanopartículas y RNP a exosomas y más allá.
Más información sobre ensayos clínicos
Si usted o un ser querido está interesado en formar parte de un ensayo clínico, puede obtener más información sobre cómo funcionan los ensayos clínicos en EE. UU. esta página y buscar ensayos actuales esta página. Siempre discuta las decisiones médicas importantes con su médico. Tenga en cuenta que los ensayos clínicos son las primeras pruebas de nuevos tratamientos médicos en humanos, por lo que son intrínsecamente riesgosos para los pacientes y nunca se garantiza su éxito.